 Новости отрасли
Новости отрасли Глобальный справочник поставщиков лабораторного оборудования 2026 года | Поставщик «под ключ»
Глобальный справочник поставщиков лабораторного оборудования 2026 года | Поставщик «под ключ»
2026-02-27
2025-11-20
2025-11-20
2025-10-13
2025-08-27
2025-08-19
 Текущие события
Текущие событияОБЩИЙ
В согласованном трехстороннем руководстве ICH по испытаниям стабильности новых фармацевтических субстанций и препаратов (далее именуемом «Основное руководство») отмечается, что испытания на световое воздействие должны быть неотъемлемой частью стресс-тестирования. Настоящий документ является приложением к Основному руководству и содержит рекомендации по испытаниям на фотостабильность.
А. Преамбула
Внутренние характеристики фотостабильности новых фармацевтических веществ и продуктов должны быть оценены, чтобы продемонстрировать, что, в соответствующих случаях, воздействие света не приводит к неприемлемым изменениям. Обычно тестирование фотостабильности проводится на одной партии материала, выбранной, как описано в разделе «Выбор партий» в основном руководстве. В некоторых случаях эти исследования следует повторить, если в продукт внесены определенные изменения (например, в состав, упаковку). Необходимость повторения этих исследований зависит от фотостабильности. характеристики, определенные на момент первоначальной подачи заявки, и тип внесенных изменений и/или корректировок.
Данное руководство в первую очередь посвящено сбору информации о фотостабильности для представления в регистрационных заявках на новые молекулярные соединения и связанные с ними фармацевтические продукты. Руководство не охватывает фотостабильность фармацевтических препаратов после введения (т.е. в условиях применения) и те заявки, которые не охвачены данным руководством. Рекомендации для родителей. Альтернативные подходы могут быть использованы, если они научно обоснованы и имеют под собой основание.
Рекомендуется систематический подход к тестированию фотостабильности, включающий, при необходимости, такие исследования, как:
i) Испытания фармацевтического вещества;
ii) Проведение испытаний фармацевтического продукта, подвергшегося воздействию внешней среды, вне непосредственной упаковки; и при необходимости;
iii) Проведение испытаний фармацевтического продукта в непосредственной упаковке;
и при необходимости;
iv) Проведение испытаний фармацевтического продукта в упаковке, предназначенной для реализации.
Объем испытаний лекарственного препарата следует определять, оценивая, произошли ли приемлемые изменения по завершении испытаний на воздействие света, как описано в блок-схеме принятия решений по испытаниям на фотостабильность фармацевтических препаратов. Приемлемыми считаются изменения в пределах, обоснованных заявителем.
Официальные требования к маркировке фотолабильных фармацевтических субстанций и лекарственных препаратов устанавливаются национальными/региональными нормативными актами.
Испытание фотостабильности новых фармацевтических веществ и продуктов.
Б. Источники света
Описанные ниже источники света могут использоваться для тестирования фотостабильности. Заявитель должен либо поддерживать надлежащий контроль температуры для минимизации влияния локальных изменений температуры, либо включить контрольный образец в темноте в той же среде, если иное не оправдано. В обоих вариантах 1 и 2 фармацевтический производитель/заявитель может полагаться на спецификацию спектрального распределения, предоставленную производителем источника света.
Вариант 1
Любой источник света, предназначенный для получения излучения, аналогичного стандарту излучения D65/ID65, например, искусственный дневной свет, люминесцентная лампа, сочетающая видимое и ультрафиолетовое (УФ) излучение, ксеноновая или металлогалогенная лампа. D65 — это международно признанный стандарт для наружного дневного света, определенный в ISO 10977 (1993). ID65 — это эквивалентный стандарт для непрямого дневного света в помещении. Для источника света, излучающего значительное количество излучения ниже 320 нм, может быть установлен соответствующий фильтр (фильтры) для устранения такого излучения.
Вариант 2
Для варианта 2 один и тот же образец следует подвергнуть воздействию как холодной белой флуоресцентной лампы, так и лампы ближнего ультрафиолета.
1. Люминесцентная лампа холодного белого света, предназначенная для получения светового потока, аналогичного указанному в ISO 10977(1993);
2. Флуоресцентная лампа ближнего УФ-диапазона с спектральным распределением от 320 нм до 400 нм и максимальной энергией излучения в диапазоне от 350 нм до 370 нм; значительная часть УФ-излучения должна приходиться на оба диапазона: от 320 до 360 нм и от 360 до 400 нм.
С. Процедура
Для подтверждающих исследований образцы следует подвергать воздействию света с общей освещенностью не менее 1,2 миллиона люкс-часов и интегрированной энергией ближнего ультрафиолета не менее 200 ватт-часов/квадратный метр, чтобы обеспечить возможность прямого сравнения фармацевтического вещества и лекарственного препарата.
Образцы могут подвергаться воздействию света одновременно с использованием проверенной химической актинометрической системы для обеспечения заданной интенсивности светового облучения, или в течение соответствующего периода времени, если условия контролировались с помощью калиброванных радиометров/люксметров.
Пример актинометрической процедуры приведен в Приложении.
Если в качестве контрольных образцов, защищенных от воздействия тепла (например, завернутых в алюминиевую фольгу), используются образцы, находящиеся в темноте, для оценки вклада изменений, вызванных термическим воздействием, в общее наблюдаемое изменение, их следует размещать рядом с исходным образцом.
ФАРМАЦЕВТИЧЕСКОЕ ВЕЩЕСТВО
Для фармацевтических субстанций тестирование фотостабильности должно состоять из двух частей: тестирование принудительной деградации и подтверждающее тестирование.
Целью исследований по принудительной деградации является оценка общего состояния. Фоточувствительность материала для целей разработки методики и/или выяснения путей деградации. Эти исследования могут включать как само фармацевтическое вещество, так и его простые растворы/суспензии для проверки аналитических процедур. В таких исследованиях образцы должны находиться в химически инертных и прозрачных контейнерах. В исследованиях принудительной деградации могут использоваться различные условия воздействия в зависимости от...
Фоточувствительность используемого фармацевтического вещества и интенсивность используемых источников света. В целях разработки и валидации целесообразно ограничивать воздействие и прекращать исследования в случае значительного разложения. Для фотостабильных материалов исследования могут быть прекращены после использования соответствующего уровня воздействия. Разработка этих экспериментов остается на усмотрение заявителя, хотя используемые уровни воздействия должны быть обоснованы.
В условиях внешнего воздействия могут наблюдаться продукты разложения, которые вряд ли встречаются в настоящее время. Эта информация должна быть сформирована в условиях, используемых для подтверждающих исследований. может быть полезен при разработке и проверке подходящих аналитических методов. Если на практике Было доказано, что они не образуются в подтверждающих исследованиях. Продукты разложения не требуют дальнейшего исследования.Затем следует провести подтверждающие исследования для получения необходимой информации. для обращения, упаковки и маркировки (см. раздел IC, Процедура и II.A.).(Информация о методологии этих исследований представлена в презентации).
Обычно на этапе разработки тестируется только одна партия лекарственного вещества, и затем характеристики фотостабильности должны быть подтверждены на одной из партий. выбран в соответствии с описанием в основных рекомендациях, если лекарственное средство явно фотостабильно или фотолабильный. Если результаты подтверждающего исследования неоднозначны, можно провести тестирование до двух Необходимо провести дополнительные партии исследований. Образцы следует отбирать, как описано в Руководство для родителей.
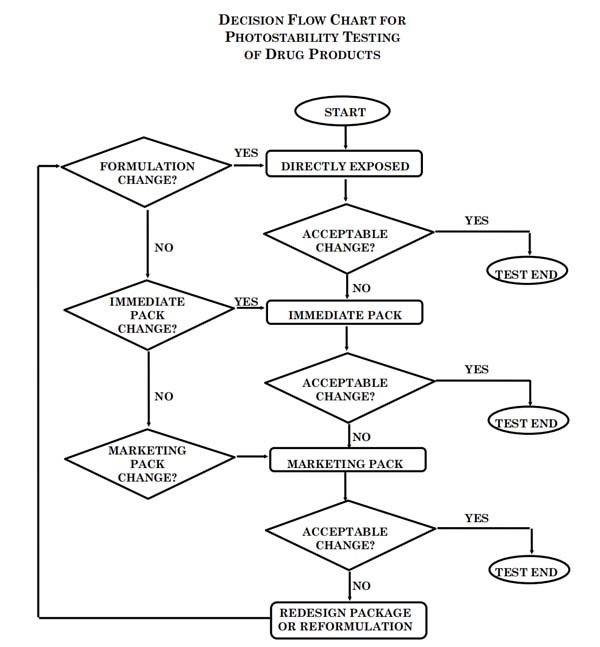
А. Презентация образцов
Следует позаботиться о том, чтобы физические характеристики образцов соответствовали... Результаты испытаний принимаются во внимание, и следует предпринять такие меры, как охлаждение и/или размещение. Образцы помещают в герметичные контейнеры, чтобы гарантировать, что воздействие изменений физических свойств будет учтено. Такие состояния, как сублимация, испарение или плавление, сведены к минимуму. Все подобные процессы минимизируются. Следует выбирать меры предосторожности, обеспечивающие минимальное воздействие на организм. Образцы, находящиеся на стадии исследования. Возможные взаимодействия между образцами и любым используемым материалом. Также следует учитывать возможность использования контейнеров или общую защиту образца. исключается, если не имеет отношения к проводимому тестированию.
В качестве прямого метода проверки образцов твердых фармацевтических веществ используется соответствующее количество Образец следует отобрать, поместить в подходящую стеклянную или пластиковую посуду и защитить. При необходимости, с соответствующей прозрачной крышкой. Твердые фармацевтические субстанции. Смесь следует распределить по всей поверхности контейнера слоем толщиной не более 3 см. миллиметры. Фармацевтические вещества, являющиеся жидкостями, должны подвергаться воздействию химически инертных веществ. и прозрачные контейнеры.
Испытание фотостабильности новых фармацевтических веществ и продуктов.
Б. Анализ образцов
По окончании периода воздействия образцы следует исследовать на предмет любых изменений. физические свойства (например, внешний вид, прозрачность или цвет раствора), а также для анализа и продукты разложения, определяемые методом, надлежащим образом апробированным для продуктов, которые могут образоваться в результате фотохимические процессы деградации.
В случаях, когда речь идет о твердых образцах фармацевтических веществ, отбор проб должен обеспечивать следующее: В отдельных тестах используется репрезентативная часть. Аналогичные соображения относительно отбора проб, такие как гомогенизация всей пробы, применяются и к другим материалам, которые могут быть не гомогенизированы. Однородный после облучения. Анализ облученного образца должен быть следующим: проводили одновременно с проведением анализа любых защищенных образцов, используемых в качестве контрольных образцов в темноте, если Они используются в тесте.
C. Оценка результатов
Исследования принудительной деградации должны быть разработаны таким образом, чтобы предоставлять соответствующую информацию для Разработать и валидировать методы тестирования для подтверждающих исследований. Эти методы тестирования должен быть способен различать и обнаруживать продукты фотолитической деградации, которые появляются в процессе подтверждающие исследования. При оценке результатов этих исследований следует учитывать следующее: Важно понимать, что они являются частью стресс-тестирования и, следовательно, не являются таковыми. предназначен для установления качественных или количественных пределов изменений.
Подтверждающие исследования должны определить необходимые меры предосторожности в производство или разработка фармацевтического продукта, а также светостойкая упаковка. необходимо. При оценке результатов подтверждающих исследований следует определить, следует ли Изменения, вызванные воздействием света, допустимы, но важно учитывать полученные результаты. от других формальных исследований стабильности, чтобы гарантировать, что фармацевтический препарат будет соответствовать определенным параметрам. Обоснованные пределы на момент использования (см. соответствующий раздел МГК «Стабильность и примеси»). (Руководящие принципы).
ФАРМАЦЕВТИЧЕСКИЙ ПРОДУКТ
Как правило, исследования фармацевтических препаратов следует проводить последовательно. начиная с тестирования полностью открытого продукта, а затем, по мере необходимости, переходя к следующему этапу. продукт сначала в непосредственной упаковке, а затем в маркетинговой упаковке. Тестирование должно... до тех пор, пока результаты не покажут, что фармацевтический продукт надлежащим образом защищен. от воздействия света. Фармацевтический препарат должен подвергаться воздействию света. описана в процедуре, изложенной в разделе IC.
Обычно на этапе разработки тестируется только одна партия фармацевтической продукции, и Затем характеристики фотостабильности следует подтвердить на одной выбранной партии. как описано в Руководстве для родителей, если продукт явно фотостабилен или фотолабильный. Если результаты подтверждающего исследования неоднозначны, можно провести тестирование до двух Необходимо провести дополнительные испытания.
Для некоторых продуктов, где было доказано, что непосредственная упаковка является Если материал полностью непроницаем для света, например, алюминиевые трубки или банки, то при проведении испытаний следует... Как правило, такие исследования проводятся только на препаратах, непосредственно подвергавшихся воздействию. Возможно, целесообразно протестировать определенные продукты, такие как инфузионные растворы, кремы для кожи. и т. д., для подтверждения их фотостабильности в процессе эксплуатации. Масштаб этих испытаний должен зависеть от обстоятельств. относится к инструкциям по применению и оставляется на усмотрение заявителя.’на усмотрение.Используемые аналитические методы должны быть надлежащим образом валидированы.
Испытание фотостабильности новых фармацевтических веществ и продуктов.
А. Презентация образцов
Следует позаботиться о том, чтобы физические характеристики образцов соответствовали... При проведении испытаний принимаются во внимание такие меры, как охлаждение и/или размещение образцов в охлажденном состоянии. Герметичные контейнеры должны быть изготовлены таким образом, чтобы гарантировать, что последствия изменений физических свойств не будут иметь значения. Снижаются состояния, такие как сублимация, испарение или плавление. Все подобные состояния Следует выбирать меры предосторожности, обеспечивающие минимальное воздействие на облучение. Образцы, находящиеся на стадии исследования. Возможные взаимодействия между образцами и любым используемым материалом. Также следует учитывать вопрос о контейнерах или об общей защите образца. исключается, если не имеет отношения к проводимому тестированию.
По возможности, при тестировании образцов лекарственного препарата вне первичного звена. в упаковке их следует представить в соответствии с условиями, указанными для фармацевтическое вещество. Образцы следует располагать таким образом, чтобы обеспечить максимальную площадь покрытия. Воздействие источника света. Например, таблетки, капсулы и т. д. следует разложить в один слой.
Если прямое воздействие нецелесообразно (например, из-за окисления продукта), образец его следует поместить в подходящий защитный инертный прозрачный контейнер (например, кварцевый).
Если необходимо провести тестирование лекарственного препарата в его непосредственной упаковке или в том виде, в котором он находится на рынке, образцы следует размещать горизонтально или поперечно относительно света. источник, выбирайте тот, который обеспечивает наиболее равномерное воздействие на образцы. Некоторые При тестировании больших объемов может потребоваться корректировка условий тестирования. контейнеры (например, дозирующие упаковки).
Б. Анализ образцов
По окончании периода воздействия образцы следует исследовать на предмет любых изменений. физический свойства (например, внешний вид, четкость) or цвет of растворение, растворение/распад (для лекарственных форм, таких как капсулы и т. д.), а также для анализа и продукты разложения, определяемые методом, надлежащим образом апробированным для продуктов, которые могут образоваться в результате фотохимические процессы деградации.
При отборе порошковых образцов необходимо обеспечить репрезентативность выборки. Эта часть используется в индивидуальных тестах.
Для твердых лекарственных форм для приема внутрь проводятся испытания. следует проводить тестирование на комбинированном образце соответствующего размера, например, из 20 таблеток или cапсулы. Аналогичные соображения относительно отбора проб, такие как гомогенизация или растворение весь образец, применимо к другим материалам, которые могут быть неоднородными после Воздействие (например, кремов, мазей, суспензий и т. д.). Анализ подвергшихся воздействию веществ. Проведение анализа следует проводить одновременно с анализом любых защищенных образцов, используемых в качестве Если в тесте используются контрольные образцы в темном режиме, то да.
C. Оценка результатов
В зависимости от масштаба изменений может потребоваться специальная маркировка или упаковка. Снизить воздействие света. При оценке результатов исследований фотостабильности следует учитывать следующее: Важно определить, допустимы ли изменения, вызванные воздействием света. следует учитывать результаты, полученные в других формальных исследованиях устойчивости, чтобы гарантировать... что продукт будет соответствовать заявленным техническим характеристикам в течение всего срока годности (см. соответствующие руководящие принципы ICH по стабильности и примесям).
Испытание фотостабильности новых фармацевтических веществ и продуктов.
ПРИЛОЖЕНИЕ
А. Химическая актинометрия на основе хинина
Ниже приведено описание актинометрической процедуры для мониторинга воздействия ближнего ультрафиолетового излучения люминесцентной лампы (на основе рекомендаций FDA/Национального института стандартов и технологий).
(Технологическое исследование). Для других источников света/актинометрических систем может использоваться тот же подход, но каждая актинометрическая система должна быть откали